以下是搜尋 "臨床試驗" 的結果

|
先健科技IBSR冠脈支架III期臨床一年隨訪:安全和有效性獲進一步確認...為IBS冠脈支架植入術後一年靶病變失敗率(TLF),是迄今為止評估IBS冠脈支架安全性與有效性的最大規模的臨床試驗。該項研究共入組1061名患者,包括II期臨床研究中使用IBS冠脈支架的200余名受試者和III期臨床研究另行入組的 |

|
美時授權引進的小細胞肺癌新藥 未來病患人數有望倍增 (2)(1795)31日宣布,該公司自國外授權引進的小細胞新藥Zepzelca(lurbinectedin),根據海外最新的臨床試驗成果,透過合併療法有機會由小細胞肺癌病人的二線用藥,晉升為一線治療後的維持治療組合藥物,在台灣可 |

|
心房顫動增中風風險!心房顫動治療創新猷,林口長庚醫院躍升亞太地區訓練中心 (6)...品質,成為國內領先的心臟外科技術教育機構,更將積極參與全球最大規模的心臟外科臨床試驗,持續提升國際醫療地位。這些臨床試驗不僅為醫院的治療提供了最新的數據支持,還讓林口長庚在心臟外科領域與國際前沿技術 |

|
創輕便乳癌篩檢設備助農村 南美洲女孩奪創業冠軍 (3)...優先獲得及時的診斷和醫療服務。Salva Health目前擁有13名員工,與哥倫比亞大型保險公司Grupo Sura合作,發展臨床試驗,並開發一款能夠預測乳癌風險的AI模型。艾古岱洛也表示,雖然美國沒有乳房攝影設備短缺或大量農村人口 |

|
打造亞太醫療新生態!「臺馬越醫藥論壇」共商亞洲健康產業發展新未來 (3)...署合作意向書,期促進台灣生醫產業拓展東南亞市場,也吸引東南亞生醫產業與臺北醫學大學的產學合作及臨床試驗。由陳建州理事長與北醫蕭育仁事業長代表簽約,並邀請多位專家在專題座談中探討國際政經局勢下,分析區 |

|
小分子褐藻醣膠二代製程 獲2024台灣創新技術雙獎肯定...技術已成功技轉「輕采國際有限公司」,並應用於「研褐二代小分子褐藻醣膠」產品,自2021年起除通過人體臨床試驗驗證,並已獲SNQ國家品質標章及2023年玉山獎最佳產品肯定。近期,輕采國際也因應台灣超高齡化社會,成功開 |

|
竟天APC201二期臨床收案將完成 2025年Q1初步數據結果 (5)...選項,並分食龐大的骨關節炎疼痛市場商機。APC201在澳洲進行一/二期臨床試驗的二期臨床收案,目前已完成85%的收案進度,預計2024年底完成二期臨床試驗,並進行數據統計與分析,2025年第一季將取得初步數據結果,公司將以 |

|
台寶生醫加速美國CDMO市場發展 現金增資案順利完成 (2)...的 FAST 平台細胞工程技術也邁向臨床階段,細胞醫療產品逐步進入臨床試驗,將加速發展調節型 T 細胞在自體免疫和器官移植抗排斥市場,啟動二期臨床試驗,進一步拓展在非癌症領域細胞治療產品的領導地位。 執行長楊鈞 |

|
修格蘭氏症、乾眼症,中西醫合治突破瓶頸!中醫「針刺療法」促進淚液分泌 (8)...複方SS-1治療修格蘭氏症的雙盲隨機安慰劑對照交叉設計臨床試驗,成功證實對免疫系統的調控及淚液分泌的改善效果。隨後,再進行「春雨清化飲」中藥茶包臨床試驗,結果顯示該配方能顯著提升患者的淚液分泌量,減少人 |

|
駐澳代表推動台澳生技合作 深化雙邊產學研交流 (4)...代表徐佑典持續促成台澳合作,他今出席於舉辦的澳大利亞生技展(AusBiotech)及與澳方產業領袖會議,針對臨床試驗合作、生技創新研發等交流。「台澳科學及技術合作協議」簽署後,生物科技成為台澳科研合作重點領域之一 |

|
破壞腫瘤和化療一次做 麻省理工開發治癌症新方法... 光療是一種創新療法,利用外部雷射注入加熱的粒子,消除附近腫瘤細胞病保留周圍組織,目前正在進行臨床試驗的光療法是利用金奈米粒子,暴露在近紅外線(near infrared light)下會散發熱量。不過麻省理工學院科學家採用 |

|
逸達向美國FDA 遞交CAMCEVI三個月緩釋劑型藥證申請 (4)...射劑之新藥查驗登記申請(New Drug Application, NDA)。逸達生技指出,此新劑型新藥藥證申請係根據成功的三期臨床試驗結果,申請CAMCEVI三個月緩釋注射劑用於晚期前列腺癌的緩解治療(palliative treatment)。試驗總計收錄144位晚期 |

|
GemVax在Neuro2024大會上發佈進行性核上性麻痺2a期臨床試驗頂線結果...24:PSP和CBD國際研究研討會」上公佈了其治療進行性核上性麻痺(PSP)的研究用多肽藥物GV1001的2a期臨床試驗(簡稱「2a期PSP臨床試驗」)的頂線結果。 PSP是一種退行性疾病,與帕金森病一樣,也會導致步態障礙、早期跌倒、垂直 |

|
艾美疫苗重磅大單品mRNA RSV疫苗獲批臨床...的商業化規模生產車間,在其mRNA技術平台上生產的疫苗也已經過臨床試驗驗證。艾美疫苗現已打通mRNA疫苗研發、生產等全生命週期的流程,在完成臨床試驗後可以迅速實現mRNA疫苗產品的產業化,加快疫苗產品的商業化進程 |

|
中裕新藥首獲美國客戶CDMO 委託生產製造服務 (2)(4147)29日表示,該公司已獲得美國客戶評選通過,針對其抗體臨床試驗藥物提供相關生產製造服務,此為中裕新藥開始提供CDMO業務後首次國外委託案件。在與客戶緊密合作協議下, |
|
|
朗齊生醫*LXP1788向TFDA補件說明後,已獲准執行實體腫瘤人體一期臨床試驗...受性、藥物動力學與療效研究的臨床一期開放標示與劑量訂定臨床試驗。四、目前進行中之研發階段:(一)提出申請/通過核准/不通過核准/各期人體臨床試驗(含期中分析)結果: 通過核准執行實體腫瘤(Solid tumor)人體一期臨床 |
|
|
安成生技用於治療EBS之AC-203向歐洲EMA申請增加於西班牙進行二/三期人體臨床試驗 (3)...皰瘡 (BP) 等。4.預計進行之所有研發階段:本試驗為多國多中心第二/三期臨床試驗,與112/04/07獲得美國食品藥物管理局(US FDA)核准的第二/三期人體臨床試驗為同一計劃。5.目前進行中之研發階段(請說明目前之研發階段係屬提出申 |
|
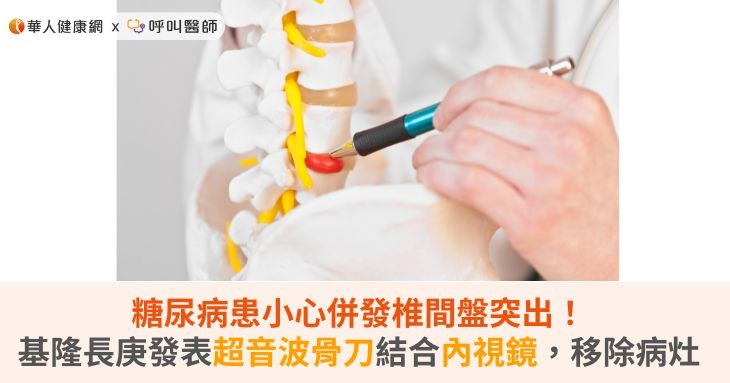
糖尿病患小心併發椎間盤突出!基隆長庚發表超音波骨刀結合內視鏡,移除病灶 (2)...用於其他高風險患者。團隊正在進一步優化這項技術,預計擴展至其他類型的脊椎手術,並期待透過更多的臨床試驗和學術交流,使這一創新手術方法受益於全球更多需要的患者。蔡松航醫師曾於全球領先的約翰霍普金斯和梅 |

|
Boomi與BASE life science合作,加速生命科學產業的數位轉型...nter for the Study of Drug Development的報告,開發一種獲得市場批准的新處方藥的平均成本約為26億美元,其中包含臨床試驗的費用和開發所需的時間成本。1嚴格的法規要求增加了開發生命週期的複雜性,企業必須應對嚴格的審批流程 |
|
|
台康生技HER2家族相似藥再推進;CDMO恢復成長...前有機會拿到銷售許可證,未來將規劃150mg與420mg兩種劑型上市,未來HER2家族的下個產品EG1206A最快本季三期臨床試驗也會收入首個受試者,成為同類型藥物進入後期臨床的領先者之一,參考先前同業授權金額,潛在市場可期。 |
